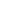Наскоро TÜV SÜD China Group (наричана по-долу „TÜV SÜD“) сертифицира електронните записи и електронните подписи на системата за управление на течен азот на Haier Biomedical в съответствие с изискванията на FDA 21 CFR Part 11. Шестнадесет продуктови решения, независимо разработени от Haier Biomedical, получиха доклада за съответствие на TÜV SÜD, включително серията Smartand Biobank.
Получаването на сертификат по FDA 21 CFR Part 11 означава, че електронните записи и подписи на системата за управление на LN₂ на Haier Biomedical отговарят на стандартите за надеждност, почтеност, поверителност и проследимост, като по този начин се гарантира качество и сигурност на данните. Това ще ускори приемането на решения за системи за съхранение на течен азот на пазари като САЩ и Европа, подкрепяйки международната експанзия на Haier Biomedical.
Получавайки сертификат от FDA, системата за управление на течен азот на HB пое по нов път на интернационализация.
TÜV SÜD, световен лидер в тестването и сертифицирането от трети страни, постоянно се фокусира върху предоставянето на професионална подкрепа за съответствие в различни индустрии, помагайки на предприятията да бъдат в крак с променящите се разпоредби. Стандартът FDA 21 CFR Part 11, издаден от Американската агенция по храните и лекарствата (FDA), предоставя на електронните записи същата правна сила като на писмените записи и подписите, гарантирайки валидността и надеждността на електронните данни. Този стандарт е приложим за организации, които използват електронни записи и подписи в биофармацевтиката, медицинските изделия и хранително-вкусовата промишленост.
След публикуването си, стандартът е широко възприет по целия свят, не само от американски биофармацевтични компании, болници, изследователски институции и лаборатории, но и от Европа и Азия. За компаниите, които разчитат на електронни записи и подписи, спазването на изискванията на FDA 21 CFR Part 11 е от съществено значение за стабилно международно разширяване, осигурявайки съответствие с разпоредбите на FDA и съответните стандарти за здраве и безопасност.
Системата за управление на течен азот CryoBio на Haier Biomedical е по същество „интелигентен мозък“ за контейнери с течен азот. Тя трансформира пробните ресурси в данни, като множество данни се наблюдават, записват и съхраняват в реално време, предупреждавайки за всякакви аномалии. Системата също така разполага с независимо двойно измерване на температурата и нивата на течността, както и йерархично управление на операциите на персонала. Освен това, тя осигурява визуално управление на пробите за бърз достъп. Потребителите могат да превключват между ръчен, газово-фазен и течно-фазен режим с едно щракване, подобрявайки ефективността. Освен това, системата се интегрира с IoT и BIMS платформа за информация за проби, което позволява безпроблемна връзка между персонала, оборудването и пробите. Това осигурява научно, стандартизирано, безопасно и ефикасно съхранение при ултраниски температури.
Haier Biomedical разработи цялостно решение за съхранение на течен азот, подходящо за всички видове дейности и обеми, фокусирайки се върху разнообразните изисквания за управление на криогенното съхранение на проби. Решението обхваща различни сценарии, включително медицински, лабораторни, нискотемпературно съхранение, биологични серии и серии за биологичен транспорт, и предоставя на потребителите цялостно технологично изживяване, включващо инженерно проектиране, съхранение на проби, извличане на проби, транспортиране на проби и управление на проби.

Чрез спазване на стандартите FDA 21 CFR Part 11, системата за управление на течен азот CryoBio на Haier Biomedical е сертифицирана за валидност на нашите електронни подписи и целостта на нашите електронни записи. Този сертификат за съответствие допълнително повиши основната конкурентоспособност на Haier Biomedical в областта на решенията за съхранение на течен азот, ускорявайки разширяването на марката на световните пазари.
Ускоряване на международната трансформация за привличане на потребители и подобряване на конкурентоспособността на световните пазари
Haier Biomedical винаги се е придържала към международна стратегия, като непрекъснато насърчава двойната система „мрежа + локализация“. В същото време, ние продължаваме да засилваме развитието на пазарни системи, насочени към потребителите, като подобряваме нашите сценарийни решения по отношение на взаимодействие, персонализиране и доставка.
Фокусирайки се върху създаването на най-доброто потребителско изживяване, Haier Biomedical засилва локализацията, като създава местни екипи и системи за бързо реагиране на нуждите на потребителите. До края на 2023 г. Haier Biomedical притежава мрежа за дистрибуция в чужбина от над 800 партньора и си сътрудничи с повече от 500 доставчици на следпродажбено обслужване. Междувременно създадохме система от центрове за обучение и опит, съсредоточени в Обединените арабски емирства, Нигерия и Обединеното кралство, както и система от складови и логистични центрове, разположени в Холандия и Съединените щати. Задълбочихме локализацията си в Обединеното кралство и постепенно възпроизвеждаме този модел в световен мащаб, като непрекъснато укрепваме нашата система за задгранични пазари.
Haier Biomedical също така ускорява разширяването на пазара на нови продукти, включително лабораторни инструменти, консумативи и интелигентни аптеки, повишавайки конкурентоспособността на нашите решения за различни сценарии. За потребителите в областта на науките за живота, нашите центрофуги постигнаха пробив в Европа и Америка, нашите лиофилизатори получиха първите поръчки в Азия, а нашите шкафове за биобезопасност навлязоха на пазара в Източна Европа. Междувременно, нашите лабораторни консумативи бяха разработени и внедрени в Азия, Северна Америка и Европа. За медицинските институции, освен решения за слънчеви ваксини, бързо се развиват и фармацевтичните хладилници, устройствата за съхранение на кръв и консумативите. Чрез непрекъснато взаимодействие с международни организации, Haier Biomedical предоставя услуги, включително изграждане на лаборатории, екологични тестове и стерилизация, създавайки нови възможности за растеж.
До края на 2023 г. над 400 модела Haier Biomedical бяха сертифицирани в чужбина и успешно доставени по няколко големи проекта в Зимбабве, Демократична република Конго, Етиопия и Либерия, както и по проекта на Центровете за контрол на заболяванията (CDC) на Китайско-африканския съюз, демонстрирайки подобрението в производителността. Нашите продукти и решения са широко възприети в над 150 страни и региони. В същото време поддържаме дългосрочно сътрудничество с над 60 международни организации, включително Световната здравна организация (СЗО) и УНИЦЕФ.
Получаването на сертификат по FDA 21 CFR Part 11 е важен етап за Haier Biomedical, тъй като ние се фокусираме върху иновациите в нашето пътуване към глобална експанзия. Това също така демонстрира нашия ангажимент да посрещаме нуждите на потребителите чрез иновации. С поглед към бъдещето, Haier Biomedical ще продължи нашия ориентиран към потребителя иновационен подход, като усъвършенства нашето глобално стратегическо внедряване в региони, канали и продуктови категории. Като наблягаме на местните иновации, ние се стремим да изследваме международните пазари чрез разузнаване.
Време на публикуване: 15 юли 2024 г.